ΔΙΑΠΑΝΕΠΙΣΤΗΜΙΑΚΟ ΚΑΙ ΔΙΑΤΜΗΜΑΤΙΚΟ ΠΜΣ «Διδακτική της Χημείας και Νέες Εκπαιδευτικές Τεχνολογίες» (ΔιΧηΝΕΤ)

ΜΗ ΑΜΦIΔΡΟΜΕΣ ΟΞΕΙΔΟΑΝΑΓΩΓΙΚΕΣ ΑΝΤΙΔΡΑΣΕΙΣ- ΗΛΕΚΤΡΟΛΥΣΗ
Στα γαλβανικά στοιχεία οι οξειδοαναγωγικές αντιδράσεις πραγματοποιούνται αυθόρμητα και οδηγούν στην παραγωγή ηλεκτρικού ρεύματος. Οι αντίστροφες αντιδράσεις όμως δεν είναι αυθόρμητες καθώς απαιτούν παροχή ηλεκτρικής ενέργειας. Το σύνολο αυτών των αντίστροφων μη αυθόρμητων αντιδράσεων είναι η ηλεκτρόλυση. Απαραίτητη προϋπόθεση για την διέλευση του ηλεκτρικού ρεύματος μέσα από την μάζα ενός σώματος είναι η ύπαρξη κατάλληλων φορέων όπως υδατικά διαλύματα ή τήγματα ηλεκτρολυτών. «Ηλεκτρόλυση είναι το σύνολο των αντιδράσεων οξείδωσης και αναγωγής που λαμβάνουν χώρα σε ένα τήγμα ή διάλυμα ενός ηλεκτρολύτη όταν εφαρμοστεί κατάλληλη διαφορά δυναμικού στα άκρα των ηλεκτροδίων». Οι συσκευές όπου πραγματοποιείται η διεργασία της ηλεκτρόλυσης ονομάζονται ηλεκτρολυτικά στοιχεία και αποτελούνται από:
· Την πηγή ηλεκτρικού ρεύματος
· Το δοχείο με τον διάλυμα ή το τήγμα ηλεκτρολύτη
· Τα ηλεκτρόδια που συνδέονται με την πηγή.

Ηλεκτρολυτικό στοιχείο.
Πηγή: Χημεία Γ' Γενικού Λυκείου
Κατά την λειτουργία ενός ηλεκτρολυτικού στοιχείου εφαρμόζεται διαφορά δυναμικού στα άκρα των ηλεκτροδίων με την χρήση πηγής ρεύματος, π.χ. μπαταρία. Λόγω της κίνησης των ηλεκτρονίων στην κάθοδο εμφανίζεται περίσσεια ηλεκτρονίων και ασκείται έλξη στα κατιόντα του ηλεκτρολύτη που βρίσκονται γύρω και υφίστανται αναγωγή. Αντίστοιχα, στην άνοδο προσελκύονται τα ανιόντα του ηλεκτρολύτη και υφίστανται οξείδωση. Τα ηλεκτρόνια που παράγονται από την οξείδωση κινούνται προς τον θετικό πόλο της πηγής με αποτέλεσμα να υπάρχει συνεχής ροή ηλεκτρονίων. Στην περίπτωση ηλεκτρόλυσης διαλυμάτων ηλεκτρολυτών, μέσα στο διάλυμα υπάρχουν μόρια νερού και τα προϊόντα ιονισμού του και καθώς και τα ιόντα του ηλεκτρολύτη. Ανάλογα της συγκέντρωσης τους μπορούν να μετέχουν σε αντιδράσεις. Τέλος αντιδράσεις μπορούν να προκαλέσουν και τα ηλεκτρόδια εάν δεν είναι αδρανή. Επειδή το δυναμικό του ηλεκτροδίου αποτελεί μέτρο ευκολίας οξείδωσης ή αναγωγής, τότε με βάση την διαφορά δυναμικού που θα αναπτυχθεί ανάμεσα στα ηλεκτρόδια, την τάση ηλεκτρόλυσης (ή αποφόρτισης), μπορεί να επιτευχθεί εκλεκτική αποφόρτιση ιόντων. Στην κάθοδο η σειρά εκφορτίσεως των κατιόντων είναι:

Σειρά εκφορτίσεως κατιόντων. Πηγή: Χημεία Γ' Γενικού Λυκείου
Στην άνοδο η σειρά εκφορτίσεως των ανιόντων είναι:
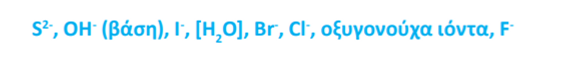
Σειρά εκφορτίσεως ανιόντων. Πηγή: Χημεία Γ' Γενικού Λυκείου
Με τις οξειδοαναγωγικές αντιδράσεις που λαμβάνουν χώρα κατά την διάρκεια μιας ηλεκτρόλυσης μπορούν να παραχθούν αέρια, να διαλυθούν μέταλλα (ηλεκτροχημική διάβρωση) ή να αποτεθούν μέταλλα (επιμετάλλωση).
Φωτογραφήθηκαν και βιντεοσκοπήθηκαν δύο ηλεκτρολυτικά στοιχεία.
-
Ηλεκτρόλυση διαλύματος NaOH με αδρανή ηλεκτρόδια γραφίτη.
-
Ηλεκτρόλυση διαλύματος CuSO4 με ηλεκτρόδια Cu και γραφίτη.
Ηλεκτρόλυση διαλύματος NaOH με αδρανή ηλεκτρόδια γραφίτη.
Στο διάλυμα γίνονται οι εξής αντιδράσεις:
Προς την κάθοδο θα κινηθούν τα Na+,τα H+ και Η2Ο. Τα Η+ προέρχονται από την διάσταση του νερού, άρα δεν είναι όξινα. Σύμφωνα με την σειρά εκφορτίσης κατιόντων προηγούνται τα H2O, τα οποία και θα αναχθούν.

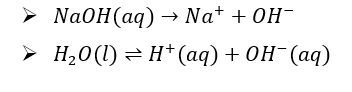
Προς την άνοδο θα κινηθούν τα OH- και H2O. Το περιβάλλον γύρω από το ηλεκτρόδιο είναι βασικό γιατί τα OH- προέρχονται από την κυρίως από διάσταση του NaOH. Σύμφωνα με την σειρά εκφόρτισης ανιόντων προηγούνται τα OH- τα οποία και θα οξειδωθούν.
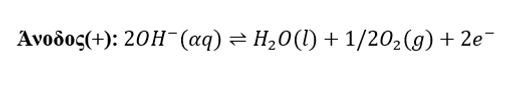
Ηλεκτρόλυση διαλύματος CuSO4 με ηλεκτρόδια Cu και γραφίτη.
Πρόκειται για ηλεκτρόλυση διαλύματος άλατος με άνοδο από μέταλλο που απαιτεί μικρότερη τάση για να οξειδωθεί από τα άλλα συστατικά του διαλύματος. Στην περίπτωση αυτή έχουμε μεταφορά μετάλλου από την άνοδο στην κάθοδο. Στο διάλυμα γίνονται οι εξής αντιδράσεις:
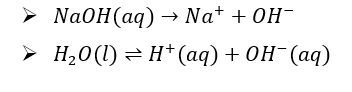
Στο λουτρό ηλεκτρόλυσης βρίσκονται τα ιόντα Cu2+, H+, SO42- και OH-. Με την εφαρμογή κατάλληλης τάσης τα κατιόντα που θα κινηθούν προς την κάθοδο είναι Cu2+ και H2O. Τα κατιόντα Cu2+ προηγούνται και μέσω της αναγωγικής διαδικασίας εκφορτίζονται δίνοντας χαλκό.

Προς την άνοδο θα κινηθούν τα SO42-, OH- και H20. Τα OH- προέρχονται από τον ιονισμό του νερού και δεν συναγωνίζονται με τα άλλα. Μεταξύ των SO42- και H2O στην σειρά εκφόρτισης προηγούνται τα H20.
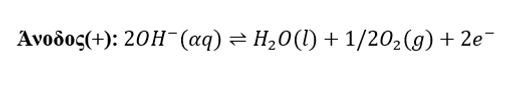
Τέλος, ο μεταλλικός χαλκός διαλύεται τροφοδοτώντας το διάλυμα με ιόντα Cu2+ τα οποία τελικά εκφορτίζονται στο ηλεκτρόδιο του γραφίτη. Δηλαδή μεταφέρεται χαλκός από την άνοδο στην κάθοδο χωρίς να μεταβάλλεται η σύσταση του άλατος στο διάλυμα.

PHOTO GALLERY
 CuSO4.mp4.00_00_45_19.Still002 |  CuSO4.mp4.00_00_21_04.Still001 |
|---|---|
 DSC_0109 |  3 |
 1 |  DSC_0164 |
 DSC_0172 |  4 |
 2 |  pic1 |
.
.


Ηλεκτρόλυση NaOH
